의료 ID 및 바코드 판독을 자동화하는 고유한 장치 인식 기술
DigiKey 북미 편집자 제공
2023-10-26
2013년 미국 식약청(FDA)은 고유 장치 식별 시스템 또는 UDI 규칙을 시행했습니다. 이 규칙은 제조, 유통 및 사용 지점에서 최신 문서를 사용하여 일관된 의료 기기 추적 및 식별 방법을 제공함으로써 환자의 안전을 향상시키는 것을 목표로 했습니다. 유럽의 의료 기기 규정 요구 사항 또는 다른 국가의 유사한 규정과 마찬가지로 미국 UDI 규칙은 보고의 정확성을 높이고 리콜 또는 부작용 사고 발생 시 분석을 용이하게 합니다.
2023년 9월 24일부터 FDA는 국민 건강 관련 항목 코드(National Health Related Item Code) 및 Device Labels and Packages(장치 레이블과 패키지)의 약물 코드 번호를 전면적으로 시행할 예정입니다. 해당 날짜 또는 그 이후에 레이블이 부착된 모든 의료 제품은 UDI 의무를 완전히 준수해야 합니다. 이 의무는 다음 사항에 영향을 미칩니다.
- 클래스 3 - 생명에 결정적인 영향을 미치는 제품(예: 맥박 조정기 및 이식된 보철물)
- 클래스 2 - 중간 정도의 중요도를 가진 제품(예: 주사기, 카테테르 및 흡수성 봉합사)
- 클래스 1 - 저위험 제품(예: 치실, 의료용 가운, 산소 마스크)
이 의무를 전면적으로 시행한다는 것은 의료 기기에 스캔 가능한 바코드가 없는 경우, 사람이 읽을 수 있는 레이블이 있고 대부분의 사용자가 제품을 일반적으로 쉽게 식별할 수 있다고 가정하는 경우에도 해당 제품이 더 이상 유효하거나 사용 가능한 제품으로 간주되지 않는다는 의미입니다. 이 전면 시행으로 의료 산업 및 의료 보험 청구에 의한 포괄적인 채택이 촉진될 것입니다.
 그림 1: 일부 핸드헬드 DPM(Direct Part Mark) 바코드 검증기는 고급 조명 및 기타 소프트웨어를 갖추고 있어 자동으로 기호를 찾고 설정을 주기적으로 반복하여 특정 DPM 마크 및 사용 중인 재료 기판의 판독을 최적화합니다. 실제로 여기 표시된 LVS-9585는 포괄적인 분석 및 보고를 위해 DPM 부품과 인쇄된 레이블을 모두 검증할 수 있습니다. (이미지 출처: Omron Automation)
그림 1: 일부 핸드헬드 DPM(Direct Part Mark) 바코드 검증기는 고급 조명 및 기타 소프트웨어를 갖추고 있어 자동으로 기호를 찾고 설정을 주기적으로 반복하여 특정 DPM 마크 및 사용 중인 재료 기판의 판독을 최적화합니다. 실제로 여기 표시된 LVS-9585는 포괄적인 분석 및 보고를 위해 DPM 부품과 인쇄된 레이블을 모두 검증할 수 있습니다. (이미지 출처: Omron Automation)
계약 기관(브랜드 보유자) 책임
미국에서는 모든 의료 제품의 IP 소유자 및 사용자 대면 브랜드가 UDI 코드에 대한 정확성과 품질에 대한 책임을 집니다. 이는 의료 제품 시장 대부분이 계약 제조 및 기타 조직의 시설에 아웃소싱되기 때문에 특히 중요합니다. 따라서 전체 공급망이 UDI를 준수하고 정확한 레이블을 생산하도록 하는 것은 계약 조직의 책임입니다.
고유한 장치 인식 기술 유래
UDI는 정적인 장치 식별자입니다. 그러나 패키지의 항목 수량을 변경하면 새로운 식별자가 필요할 수 있습니다. 발행 기관은 이러한 세부 사항이 구별되는 방식을 지시합니다. 이와 마찬가지로 장치의 포장 멸균 조건을 변경하면 장치 식별자도 변경될 수 있습니다. 장치의 목적지 시장(장치가 판매될 국가), 레이블 언어 또는 CE 마크를 변경해도 장치 식별자를 변경해야 할 수 있습니다.
UDI 규칙 이전에 의료 기기 제조업체는 제품에 특정 부품 번호 레이블을 부착했을 수 있습니다. 유통업체는 해당 부품 번호를 변경한 후 의료 제공자나 병원에서 부품 번호를 다시 변경해야 합니다. 환자에게 도달하기 전에 모든 기관에서 부품 번호를 변경할 가능성이 있기 때문에 제품 추적, 리콜 처리, 위조 방지 또는 효율적으로 새 재고를 정확하게 주문하는 것은 거의 불가능했습니다.
관련 문서: 견고한 추적 가능성 솔루션 구현
현재 UDI라고 하는 표준화된 영구 식별자가 모든 장치에 제공되어 있어 모든 기관이 보다 빠르고 정확하게 장치를 식별할 수 있으므로 궁극적으로 의료 오류를 줄일 수 있습니다. 이 UDI는 다음과 같은 2가지 주요 데이터 조각을 포함하는 영숫자 코드입니다.
- 장치 식별자
- 생산 식별자
장치 식별자는 지정된 장치에 할당되는 정적 레이블로 레이블 업체(일반적으로 장치 제조업체) 및 장치의 특정 모델 번호를 나열합니다. 반면 생산 식별자에는 다양한 데이터가 포함되며 포함할 수 있는 대부분의 데이터는 선택 사항입니다. 여기에는 로트 코드, 배치 코드, 일련번호, 만료 일자 및 제조 일자가 포함될 수 있습니다. 간단히 말해, 선택적 데이터는 제조업체 또는 레이블 업체가 장치 추적을 지원하는 데 필요하다고 판단하는 모든 데이터가 될 수 있습니다.
모든 UDI 레이블은 다음의 2가지 형태로 이 정보를 표시해야 합니다.
- 사람이 읽을 수 있는 형식(기본적인 텍스트)
- 기계가 판독할 수 있는 형식(바코드 또는 RFID 판독기로 판독 가능)
장치가 여러 의료 응용 분야를 충족할 수 있는 경우 UDI는 포장이 아닌 장치에 직접 표시되어야 합니다. 이 규칙은 여러 번 사용할 수 있는 장치에도 적용됩니다.
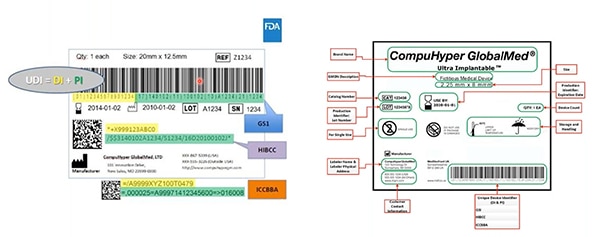 그림 2: UDI 발행 기관인 GS1, HIBCC 및 ICCBBA가 UDI를 생성하고 UDI에 허용되는 기호를 할당하고 UDI와 인터페이스할 수 있는 기술을 정의하며 UDI 마크에 필요한 품질을 지정합니다. 이 샘플에서 노란색으로 강조 표시된 것은 장치 식별자이며 녹색으로 강조 표시된 것은 생산 식별자입니다. 기타 요소에는 사람이 읽을 수 있는 정보가 포함되고 또한 기계가 판독할 수 있는 바코드로 인코딩됩니다. (이미지 출처: FDA)
그림 2: UDI 발행 기관인 GS1, HIBCC 및 ICCBBA가 UDI를 생성하고 UDI에 허용되는 기호를 할당하고 UDI와 인터페이스할 수 있는 기술을 정의하며 UDI 마크에 필요한 품질을 지정합니다. 이 샘플에서 노란색으로 강조 표시된 것은 장치 식별자이며 녹색으로 강조 표시된 것은 생산 식별자입니다. 기타 요소에는 사람이 읽을 수 있는 정보가 포함되고 또한 기계가 판독할 수 있는 바코드로 인코딩됩니다. (이미지 출처: FDA)
모든 장치는 글로벌 UDI 데이터베이스에 등록되어 리콜 시 추적할 수 있으며 해당 장치에 대한 정보에 공개적으로 접근할 수 있어야 합니다. FDA 승인 발급 기관은 장치 제조업체가 제품에 부착할 수 있는 고유 식별자를 생성할 수 있는 권한을 부여받았습니다.
관련 백서: Staying Current on Traceability(유통 경로에 대한 최신 상태 유지)
UDI 스캐닝 기술 및 기법
UDI 레이블은 제조부터 사용에 이르기까지 여러 방법으로 검증될 수 있습니다.
인라인 검증은 막대한 수의 제품이 생산될 때 빠르고 정확하게 처리될 수 있도록 대규모 기계로 통합된 기술을 사용하여 시행됩니다. 고급 소프트웨어에서 지원하는 이러한 기술은 산업용 레이블 프린터의 형태를 띠기도 합니다. 이러한 프린터는 레이블 생산 시점에서 UDI 정보가 생성되는 즉시 까다로운 업계 표준에 따라 판독될 수 있는지 확인하기 위해 자체 인라인 검증을 수행할 수 있습니다. 예를 들어 Omron Automation V275 검증기는 FDA를 준수하기 위해 ISO 15426과 발급 기관의 GS1 표준을 준수할 수 있도록 Zebra 감열식 프린터와 함께 사용됩니다.
관련 문서: Omron 추적 가능성 솔루션
다른 곳에서는 인라인 검증이 자동화된 생산 라인의 특수 머신 비전 측면 컨베이어의 형태를 취하며 고속 생산 라인의 고혼합 제품에 대한 UDI 레이블 부착 시 매우 빠르고 정확하게 검증할 수 있도록 바코드 판독을 통합합니다. Omron Automation MicroHAWK 제품은 Ethernet/IP 및 PROFINET을 포함하는 소형 구조 및 연결 옵션으로 보완된 고급 센서가 탑재되어 있어 이 분야에서 탁월합니다.
관련 문서: Avoid the Liability of Mislabeling(잘못된 레이블에 대한 책임 방지)
반면 오프라인 UDI 검증은 품질을 보장하기 위한 레이블 배치 샘플링에 가장 적합합니다. 의료 기기가 시설에서 출고되거나 시설에 입고될 때 샘플 테스트에 종종 사용되는 오프라인 검증은 유통 여정에서 온라인 검증 시스템 업스트림을 보완할 수 있습니다.
 그림 3: 제품에 직접 표시된 UDI에는 부착된 레이블에 인쇄된 UDI에 사용되는 검증기와는 다른 검증기를 사용해야 합니다. (이미지 출처: Omron Automation)
그림 3: 제품에 직접 표시된 UDI에는 부착된 레이블에 인쇄된 UDI에 사용되는 검증기와는 다른 검증기를 사용해야 합니다. (이미지 출처: Omron Automation)
사실 모든 의료 유통 및 의료 운영은 ISO 준수 검증기를 사용하는 이점을 얻을 수 있습니다. Omron의 LVS 95XX 계열 오프라인 UDI 검증 제품을 생각해 보겠습니다. 이러한 제품이 사용되는 분야는 다음과 같습니다.
- 코드가 생성되는 레이저 마킹 스테이션 및 레이블 프린터
- 코드가 제품에 적용되는 위(코드 생성 영역과 분리될 수도 있고 분리되지 않을 수도 있음)
- 템플릿, 서식 및 기타 코드 요소가 확인되는 품질 관리 스테이션
오프라인 UDI 검증기 변형 지정
주어진 응용 분야에 가장 적합한 오프라인 UDI 검증기는 여러 파라미터에 따라 달라집니다.
바코드 크기: 렌즈 초점 거리 및 센서 크기로 정의된 넓은 시야각을 가진 식별자를 사용하면 큰 바코드를 스캔하기가 더 쉽습니다. Omron Automation의 LVS-9510 데스크톱 UDI 식별자를 생각해 보겠습니다. 이 제품 계열은 선형 및 2D 레이블을 모두 판독할 수 있습니다. 5개의 서로 다른 버전은 각기 다른 시야각을 가지므로 설계자는 검증이 필요한 바코드의 크기와 호환되는 버전을 선택할 수 있습니다. 결합 기능을 통해 시야각을 초과하는 바코드의 등급을 지정할 수 있습니다.
또한 모든 LVS-9510은 코드를 평가하고 문제 지점을 식별 및 강조 표시하는 데 필요한 기호와 애퍼처를 자동으로 결정할 수 있습니다.
 그림 4: ISO 표준을 충족하는 바코드는 선형(1D) 및 2차원(2D) 코드 모두를 검증할 수 있는 장비로 더 쉽게 검증됩니다. 이러한 장비 중 일부는 코드를 평가하는 데 필요한 기호와 애퍼처를 결정하고 문제를 식별 및 강조 표시합니다. 여기 표시된 LVS-9510은 시야각보다 큰 바코드의 등급을 지정할 수 있는 결합 기능이 있습니다. (이미지 출처: Omron Automation)
그림 4: ISO 표준을 충족하는 바코드는 선형(1D) 및 2차원(2D) 코드 모두를 검증할 수 있는 장비로 더 쉽게 검증됩니다. 이러한 장비 중 일부는 코드를 평가하는 데 필요한 기호와 애퍼처를 결정하고 문제를 식별 및 강조 표시합니다. 여기 표시된 LVS-9510은 시야각보다 큰 바코드의 등급을 지정할 수 있는 결합 기능이 있습니다. (이미지 출처: Omron Automation)
바코드 유형: 스캐너는 HIBCC, ICCBBA 또는 (가장 일반적으로 2023년 현재) GS1로 알려진 발행 기관에서 할당한 바코드 형식을 판독해야 합니다. GS1은 UPC, 선형 바코드, 2D 데이터 매트릭스 바코드의 크기 형식 및 해상도를 지정합니다.
UDI 마크 위치: 의료 기기의 DPM(Direct Part Marking)을 생각해 보겠습니다. 특히 외과용 기구 및 인체 삽입형 기기를 식별할 경우 이러한 마킹이 매우 작을 수 있습니다. 이러한 DPM UDI를 판독하고 검증하기 위해 Omron의 LVS-9580 및 LVS-9585 초고밀도 핸드헬드 검증기는 특수 렌즈를 갖추고 있어 셀 크기가 0.002인치에 달하는 DPM을 포함하여 수많은 DPM 등급을 지정할 수 있습니다. LVS-9580 및 LVS-9585 내부의 산업용 렌즈는 일관된 판독 정확도를 보장합니다. 가장 정교한 것은 스캐너에 내장된 고도로 제어 가능하고 눈금 표시가 가능한 조명 기술입니다. 여러 시야각과 함께 조명을 사용하여 캡처된 UDI 이미지를 즉시 최적화할 수 있습니다. 이는 코드 표준에서 사후 수정이나 이미지 조작을 허용하지 않기 때문에 특히 중요합니다.
UDI 스캐너 소프트웨어에 대한 추가 정보
최대한의 효율성을 위해 검증 하드웨어를 지원하는 UDI 소프트웨어는 직관적인 형식으로 진단 정보를 표시해야 합니다. 이 소프트웨어는 ISO 정의 파라미터에 따라 UDI 코드의 등급을 지정해야 하며(가독성을 확인하는 것이 가장 중요), 일련의 UDI 스캔에 대한 악화 문제도 추적하는 것이 이상적입니다.
Omron은 모든 UDI 스캐닝 하드웨어에 필요한 모든 소프트웨어를 포함합니다. 이 소프트웨어는 빠르게 진화하는 규정 및 새로운 산업 법규에 보조를 맞추기 위해 정기적으로 업데이트됩니다.
Omron 스캐너 소프트웨어의 주요 기능은 코드 구문을 처리하는 것입니다. 즉, 모든 바코드 또는 2D 코드는 제품 유형, 로트 번호, 해당 수량, 만료일, 배송 정보 등을 포함한 모든 적절한 정보를 정확하게 추출해야 합니다. 결과로 생성되는 데이터 문자열은 진화하는 요구 사항, 방법론 및 의료 제품 대상에 맞춰 특정 방식으로 형식이 지정되어야 합니다.
스캐너 제조업체에서 정기적으로 업데이트되는 소프트웨어를 통해 최종 사용자는 새로운 코드가 출시되더라도 최신 상태를 유지할 수 있습니다.
결론
미군은 한때 의료 산업의 UDI 시스템처럼 UID 제품 추적 시스템을 전적으로 도입하려고 했습니다. 그 목적은 완성된 레이시언 무기부터 일부 특수 응용 분야를 위해 소규모 장비에서 공급되는 제어 기판에 이르기까지 모든 것을 포함하여, 군사 시설에서 손실, 복제, 계산되지 않은 보급품과 관련된 막대한 낭비를 줄이는 것이었습니다. 오늘날 UID는 사용 수준이 혼합되어 있습니다.
UDI 의무는 이와 같이 되진 않을 것입니다.
UDI 채택을 유도하는 주문은 간단합니다. 바로 레이블이 곧 제품이라 점입니다. 결국 잘못된 레이블은 의료 직원의 시간을 낭비하고 의료 기기가 폐기되는 일련의 사건을 일으킬 수 있습니다. 따라서 UDI는 장치, 패키지, 케이스 및 팔레트 수준과 같은 모든 포장 층에 나타나야 합니다. 멸균 시일 내부에 있는 멸균 의료 기기의 UDI는 특히 중요합니다. 해당 장치 유형을 검증하기 위해 시일을 뜯는 것이 허용되지 않기 때문입니다.
FDA가 2023년 9월 24일에 시작하는 UDI 지침을 완전히 준수하도록 요구함에 따라 의료 제품 검증을 위한 고급 스캐닝 기술은 자동화 제조업체뿐만 아니라 기계 제조업체 및 최종 사용자에게 가장 중요해질 것입니다.
이러한 스캐너는 광범위한 실험실, 의료 및 임상 진단 장비의 레이블을 확인하기 위해 매우 구체적인 FDA UDI 요구 사항을 충족할 수 있습니다. 오프라인 바코드 검증기는 유통 경로, 인라인 머신 비전 및 고급 DPM 판독기를 극대화합니다.

면책 조항: 이 웹 사이트에서 여러 작성자 및/또는 포럼 참가자가 명시한 의견, 생각 및 견해는 DigiKey의 의견, 생각 및 견해 또는 DigiKey의 공식 정책과 관련이 없습니다.







